詳細な診療情報 心臓血管外科
手術件数の推移と成績(2022年10月24日現在)
手術件数の推移
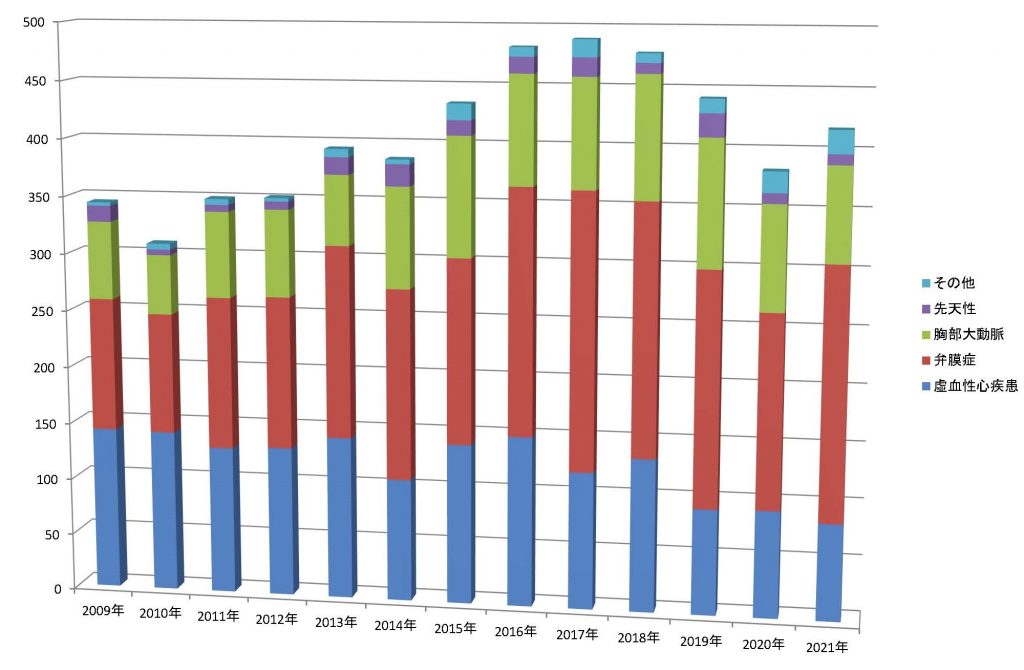
横スクロールでご覧ください。
| 年 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 虚血性心疾患 | 143 | 142 | 130 | 132 | 143 | 108 | 141 | 150 | 121 | 135 | 93 | 94 | 85 |
| 弁膜症 | 116 | 105 | 133 | 133 | 168 | 167 | 162 | 215 | 242 | 220 | 206 | 170 | 221 |
| 胸部大動脈 | 68 | 52 | 75 | 76 | 61 | 88 | 104 | 95 | 95 | 106 | 110 | 91 | 82 |
| 先天性 | 14 | 5 | 6 | 7 | 15 | 19 | 13 | 14 | 16 | 9 | 20 | 9 | 9 |
| その他 | 3 | 5 | 5 | 3 | 7 | 4 | 14 | 8 | 15 | 8 | 12 | 18 | 20 |
| 総数 | 344 | 309 | 349 | 351 | 394 | 386 | 434 | 482 | 489 | 478 | 441 | 382 | 417 |
各種成人心臓手術の説明と当科の特徴
1. 冠状動脈バイパス手術
心臓の血管に血流路を追加する手術です。狭心症や心筋梗塞の患者さんが対象となります。心臓の筋肉に血液を送る冠状動脈の硬化により血液が不足した部分に、自分の体の他の部分からもらった血管をつなぎ、血流を良くする手術です。2012年2月には天皇陛下もこの手術をお受けになりました。
循環器内科医が行う、風船治療、ステント治療と異なり、悪くなった部分を直接的に広げる代わりに、そこを飛び越えて血液を流します。
3枝病変(主要な冠状動脈の3方向の枝全てに動脈硬化がある)に対して、薬物療法と比較してバイパス手術は予後の改善(寿命を伸ばす)が統計調査によって証明されています。しかし同じ3枝病変に対してステント治療が薬物治療より優れているかどうかはまだはっきりしていません。ステント治療は特に急性心筋梗塞、切迫梗塞の急性期治療成績を明らかに改善した功績がありますが、安定狭心症に対する効果は否定的な報告が増えています。
バイパス手術は安定狭心症も含め、さらに長期予後の改善に有効な治療であり得意分野が異なります。
当院の手術の特徴
各患者さんの条件に合ったバイパスのデザインをします
先々代主任部長の早瀬医師の時代、20年以上前から動脈グラフト(バイパスに使用する血管をグラフトと呼びます)を先駆けて使用し長期多数例の実績から各グラフトの特徴を熟知しています。バイパス手術で最も大事なことは、グラフトのデザイン、使い分けです。単純に体外循環を使わなければ良い手術、動脈を使えば良い手術ではありません。
例えば、「両側内胸動脈と胃大網動脈をできるだけ使用する」という方針を全部の患者さんに当てはめようとすれば必ずそれに適さない条件の患者さんが不利益を被ります。1つのパターンで何でも解決しようとしてもうまくいかないのは医療に限らず当然のことではないでしょうか。左右の内胸動脈、腕の動脈、胃の動脈、下肢の静脈を各患者さんの条件に合わせて使用します。一般に長期開存に優れるのは動脈グラフトですが、あえて静脈を使った方が良い場合もかなりあります。
オフポンプCABG手術を原則としますが、オンポンプ手術との両方に習熟しています
体外循環は、弁膜症手術の場合には必ず使いますが、これがそんなに悪いものであれば弁膜症の手術ができなくなってしまいます。体外循環を使うと脳梗塞が起きるとか、インターネットでいろいろ書いてあるのを弁膜症の患者さんが見たら不安になってしまいますね。
体外循環の進歩が複雑な心臓手術や大動脈瘤手術を可能にしてきたのは事実であり、むやみに恐れるべきものではありません。
実際は、「動脈硬化の特に強い人の場合体外循環の悪影響が出やすい」、「長時間使用は好ましくない」のであり、そうでない場合はそれほど心配することはありません。そもそも体外循環を使わなくても動脈硬化の酷い人は術後の一時的なボケ症状や脳梗塞は起こりやすいので注意が必要です。
実のところ当院では2010年1月以降はよほど状態の悪い患者さん以外は体外循環を使わないオフポンプ手術を標準としており、結果的に予定で行う単独冠動脈バイパスのほとんどはオフポンプ手術です。
弁膜症との同時手術で体外循環を使用する場合は、できるだけ体外循環時間を短くするようにしています。オンポンプ手術は、オフポンプに比べて決して易しいわけではなく、手早く吻合を終える技術がないと長時間体外循環となり患者さんへの悪影響が出やすくなります。予定手術の入院死亡率は、個々の病態により当然異なりますが平均データを取ると1%以下でした
左室瘤、左室縮小形成術
心筋梗塞により左心室の一部、あるいは全体が大きく膨らんで心不全になることがあります。膨らんだ心臓の一部を切って縮めて心臓を元の形に近く戻してやることで心不全を改善する手術です。私達は今まで60人以上の方に行っています。
この手術の場合、ドール先生の方法、バチスタ先生の方法、さらにそれらの変法も心臓を切って縮めること自体は大きな針で縫うだけの簡単な手技です。問題はどのような患者さんに行うかという「手術適応」の決め方です。虚血性の心拡大の場合、通常は心臓の前側の壁を縮めます。この時少なくとも回旋枝または、右冠動脈の領域のいずれかが梗塞でなく健常に近い状態で残っていることが必要です。
良い適応の場合心不全がかなり劇的に改善します。しかし場合によっては縮小せず、血管のバイパス手術だけにしておいた方がかえって良いこともあります。当院では当初より上記の原則に従い過去15年左室縮小形成を行ってきましたが、数年前心臓の拡大だけを条件にやみくもにこの手術を行っても無効であるとの大規模試験の結果(STICHトライアル)が示されました。この結果について左室縮小手術を推進していた外科医からは批判も多い試験ですが、試験のデザインからすれば当然の結果が出たと私は考えています。ただし、このトライアルの結果を、左室形成手術自体の効果が否定されたように誤解してはなりません。左室形成が有効な患者さんは存在しますが、それは従来考えられていたよりも厳密に見極めなければならないということです。
![]()
2.弁膜症手術
心臓がポンプとして働くために、心臓の中には弁が4つ入っています。その中で体に血液を送り出す左心室の入り口と出口にある僧帽弁(そうぼうべん)と大動脈弁(だいどうみゃくべん)、さらに三尖弁が主に手術の対象となります。
僧帽弁膜症
僧帽弁逆流に対しては弁の硬化を伴った場合以外は基本的に弁の修理(弁形成術)が可能です。弁の一部がまくれ返って逆流が起きる病態(プロラプス prolapse)に対する手術はすでに確立されており、比較的容易です。病変部分を切り取る方法と、ゴアテックス糸の人工腱索を付ける方法を基本としています。さらに弁輪部の補強のため人工弁輪(芯の入った化学繊維のバンドのようなもの)を縫いつけます。
硬い小さな人工弁輪(リング)を付けると逆流は止まりやすくなりますが、術後の超音波検査で見ると出来上がりが不恰好となります。小さすぎない弁輪補強バンドまたはリングを用いて、あまり弁輪縫縮に頼らない出来上がりの美しい形成を心掛けています。
当院では従来形成が困難とされた弁が突っ張って動きが制限されたり、広範に破壊された場合も自己心膜やゴアテックス膜を使った新しい形成法で手術が可能となっています。
僧帽弁が硬く狭くなる「僧帽弁狭窄」の場合は基本的に人工弁を用いた弁置換となります。
人工弁には2つのタイプがあります。牛の心膜やブタ大動脈弁などを用いた生体弁と、セラミックカーボンでできた機械弁です。
僧帽弁の場合は70歳以上、大動脈弁の場合は65歳以上で生体弁をおすすめしていますが、事前に弁の選択は患者さんと話し合っています。現在、僧帽弁膜症のほとんどを数センチの皮膚切開で内視鏡補助下に行うMICS(ミックス)手術で行っています。ミックス僧帽弁手術は、右の乳房の横辺りの皮膚を3~5センチほど切開します。術後は、特に女性の場合ほとんど創が正面から見えません。
大動脈弁膜症
人工弁を用いた弁置換手術を基本としています。近年は高齢者の大動脈弁狭窄症が増加しています。マルファン症候群による弁周辺の拡大(大動脈基部拡張症)に起因する大動脈弁逆流には人工血管置換と弁の形成(David手術)を行っています。また、上行大動脈の拡張に伴う大動脈弁逆流に対しても形成手術を行っています。この2つはうまくいきやすい手術です。若年者の二尖弁の場合も形成は比較的容易です。ただし、大動脈弁位の場合牛心膜やブタ大動脈弁を用いた生体弁による弁置換が極めて良い遠隔成績を示すことがすでに証明されています。弁形成を行うにしても生体弁の成績を凌駕できる方法の確立が必要です。当院は教育病院ではありますが大学や研究機関ではありませんので、あまり実験的な治療を行うのではなく患者さんにとって最も妥当と思われる方法を洗練された技術で提供すべき立場にあると考えます。
Bentall(ベントール)手術に生体弁を用いる、いわゆるBio-Bentall手術も再弁置換が容易な方法を考案して行っています。できるだけ弁温存手術を行う方針ではありますが、弁の変形がある時に無理に形成するよりは生体弁で15年保たせて再弁置換するほうが良い場合もあるという考えです。
なお現在単純な大動脈弁置換の多くを、数センチの皮膚切開で行うMICS手術で行っています。経カテーテル的大動脈弁植え込み術(TAVI、TAVR)は2015年2月に施設認定を取得し、軌道に乗っています(TAVIについて)。
![]()
MICS(ミックス)手術、創が小さく痛みの軽い心臓手術、胸を開けない心臓手術
指の長さ以下の創から心臓手術ができると言ったら信じますか?当院ではこの手術を2010年以降、2018年4月までに680人以上の方に行いました。2014年10月にはMICS手術に関する日本胸部外科学会卒後教育セミナー、アドバンストコースの講師を私、伊藤が務めました。2016年7月、日本低侵襲心臓手術学会第1回定期学術集会JAPANミックスサミットを当科が当番主催しました。2016年10月には、ヨーロッパ胸部外科学会で、内視鏡下僧帽弁MICSのオーラルプレゼンテーションをしました。2017年6月にはローマで開催されたMICSの国際学会ISMICSにて招請プレゼンテーションを行いました。
一般に時間がかかるのが欠点とされてきましたが、単純な僧帽弁形成のみの手術では最短2時間、平均でも3時間前後まで手術時間が短縮し、通常の方法と遜色ないか、かえって早く終わります。立体視ができる3D内視鏡を近年導入してからさらに手術がやり易くなりました。心臓手術後の患者さんの傷は通常、胸の真ん中、首の少し下からみぞおちまで25センチほどの縦一文字の傷となります。手術の際にはその下にある胸骨(きょうこつ)という平たいカマボコ板のような骨を半分に切って広げると、心臓から大動脈まで一目で見渡せる良好な視野が得られ、あらゆる種類の心臓手術が可能となります。これは標準的方法であり、当院でも基本的にはこの方法で手術をします。しかしこの方法では目立つ場所に大きな傷ができること、骨を大きく切るため骨髄からの出血や骨の癒合不全、さらには骨の感染(胸骨骨髄炎)という命に関わる危険な合併症が生じる場合が稀ですがあります。
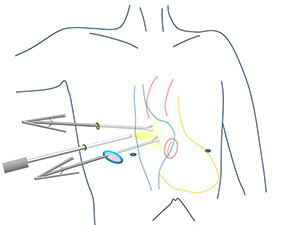
当院では弁膜症手術(大動脈弁置換、僧帽弁形成/置換)の場合最近は3センチから7センチほどの小さな傷で、胸骨を切らずに手術を行っています。この手術方法はMICS(ミックス Minimally invasive cardiac surgery)と呼ばれています。写真1は僧帽弁形成手術後の患者さん、写真2a、2bは大動脈弁置換の患者さんのものです。僧帽弁手術の場合は右乳房の少し下を数センチ切り、肋骨の間の隙間から手術をします。女性の僧帽弁手術の場合創が乳房に隠れ腕を上げない限りほとんど判りません。青い丸で囲った部分が創です。心臓を手術したとはにわかに信じがたい創ではないでしょうか?僧帽弁は以前から、大動脈弁置換も最近は完全内視鏡下に行い、開胸器も不要となりました。
3センチの創から行う僧帽弁形成手術(動画1)、右脇の下から行う大動脈弁置換手術(動画2)をご覧ください。手術シーンが映っていますので、そのような画像が苦手の方はご注意ください。
大動脈弁の場合、現在他院(世界中でも)でMICSとして行われているのは指が大動脈弁に直接届く範囲の前胸部に創を作るので結局正面に見えてしまいます。当院で開発した(下記論文14)内視鏡補助で行う新しい方法では脇の下を切りますので、写真2aのように正面からは創は事実上ほとんど判らないと言えます。青の丸の部分に創があります。側面で、さらに腕を上げてようやく創が判ります(写真2b)。国内で他に2~3の施設でこの方法を採用し始めています。
MICS手術は、第一には女性の方で創の見栄えを気にする方には間違いなくメリットがあります。さらに高齢で骨が弱くなっている方にも、胸骨を切らないので骨の治りが悪いなどの問題が起きません。
傷が小さいこと自体が術後の回復を早める治療的メリットもありますので、MICSは男性も含め全ての成人が対象となります。
さて、デメリットは当然予想されるように術野が制限され手術に必要とされる技術的ハードルが高くなります。また、体外循環技術にも工夫が必要となります。術野が深くなり指もまったく届きませんので、専用の細長い手術器具や内視鏡カメラも利用して手術を行います。
MICS(ミックス)手術は難しい?一般的治療として保険診療になりました
MICSには超絶な技巧を要するわけではありませんが、体外循環などのノウハウと慣れが必要です。私は今まで3,000人ほどの心臓手術を執刀していますが、MICS手術を始める前には器具に慣れるため、それなりの練習を要しました。難しいか簡単かと言えば難しい部類に入りますが、それは主に今までの方法と手術環境が違うため馴染みがないことによります。僧帽弁の場合、正中切開よりもMICSの方が弁を真正面から見ることができ、さらに内視鏡の超近接視を用いて詳細な観察が可能ですので、かえってやりやすい面もあります。さてあなたが患者さんの場合、今このページを読んで主治医の先生にMICS手術のことを聞いたら、場合によると「難しい心臓の手術だから、大きな創でやった方が良い」という返事が返ってくるかもしれません。しかし、日本でも2018年4月より胸腔鏡下弁形成術、胸腔鏡下弁置換術が正式な保険術式となりました。標準治療として国に認められたわけです。MICSはもはや一部の医師が行う特殊な手術ではなく、一般的選択肢として最初から患者さんに提示されるべき手術となりました。手術時間も2~3時間で終わりますので、少なくとも当院においては「時間がかかる」というのも過去の話になりました。今回MICSの手術手技料は上がりましたが、患者さんの金銭的負担は心臓手術の場合月間の負担限度額を超えますので、結果的に通常の開胸手術の場合と同等です。冠動脈バイパス手術の場合や大動脈瘤手術の場合などは標準的な胸骨正中切開をします。
二弁(大動脈弁と僧帽弁)手術も内視鏡MICSで可能です
他院では多分、MICSを行っている施設であっても「二弁手術だからMICSではできない」と言われることが大半でしょうが、当院では可能です。僧帽弁MICSと大動脈弁MICSをともに同じセッティングで3D内視鏡を使って行うため、自ずと二弁手術も可能となります。相当込み入った組み合わせであっても可能です。完全胸腔鏡下二弁手術を30例近くも行っている施設は世界で他にないと思います。下の写真のように二弁手術だからと言って創が大きくなることはありません。
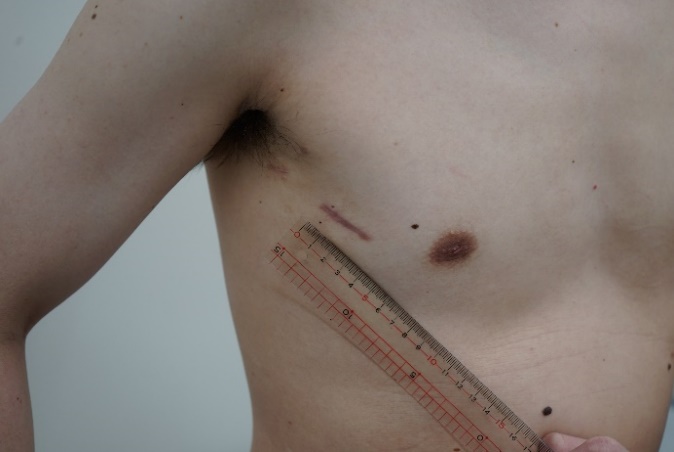
僧帽弁形成、大動脈弁形成同時手術6カ月後手術創写真
単弁の弁膜症でも個々の患者さんの条件に応じて、MICSよりも通常の切開の方が良い場合もありますので個別にご相談ください。特に、大動脈、足の動脈の硬化がある場合は正中切開の方が適しています。
ロボット(ダビンチ)手術
当院はロボット心臓手術関連学会協議会の認定施設となっており、私伊藤が術者認定を取っています。当院には最新のダビンチXiが導入されています。
ロボット手術は内視鏡手術の一種であり、内視鏡下MICS手術と似ています。内視鏡手術の経験が多いので、ダビンチ導入もスムーズにできました。ともに開胸器を使わないので術後の痛みは相当軽く済みます。ロボットと言っても自動で手術してくれるわけではなく、人間の操作を伝えるものです。結局術者次第である点は変わりません。ダビンチのアームは、通常の内視鏡器具よりも部分的には自由な動きができます。現在保険診療で行えるのは僧帽弁の形成手術に限られます。僧帽弁置換、大動脈弁置換にはロボットアームのカートリッジに石灰化弁を切るのに適したものがないのでそもそも技術的に不可能です。下に述べる心房中隔欠損、心室中隔欠損、左房粘液腫はロボットでも可能ですが、保険適応がないので自費診療になってしまいます。これらの手術はMICSで簡単にできるため、現状ではあえてロボットを使うこともないと思います。

その他の疾患に対するMICS手術、ASD、左房粘液種に対するMICS手術
先天性の心房中隔欠損症(ASD、atrial septal defect)、心室中隔欠損症(VSD、perimembranous type)、左房粘液種切除にもMICS手術は可能です。ASDの場合、小児であまり体格が小さいと難しいため、おおむね身長140センチ以上ぐらいから可能です。小学校高学年以上~成人を対象に行っています。ASDの多くは現在手術でなくカテーテル経由の栓子(アンプラッツァー)により小児科、循環器内科にて治療されています。これで治ればそれに越したことはありません。しかし3割ほどの方で欠損孔の形態が栓子による閉鎖に適合せず、手術が必要となります。その場合MICS技術を用いて行うと、特に女子児童の場合胸骨正中切開よりも圧倒的に創が目立ちにくいメリットがあります。当院の内視鏡下MICSの場合、創の大きさは500円玉ワンコイン、2.5センチの皮膚切開で済みます。もはや、ASD手術を正中切開で受ける理由は何もないと考えています。昔は「就学期前にASDを治しておこう」という考えで、5歳以下のお子さんに手術をすることがよくありました(今でもあるかもしれません)が、今はカテーテル治療やMICSがあります。ASDは自然経過でも症状が出るのは一般に大人になってからですので、小さい時に慌てて手術を受ける必要は必ずしもないのです。ASD手術の動画です。(血液などが映りますので苦手な方はご注意ください)
左房粘液種というのは、心臓腫瘍の大半を占める病気で左心房の中にできるゼリー状の良性腫瘍です。そのため、同じく左心房を開ける僧帽弁MICSの技術を応用して数センチの創で切除可能です。(伊藤)
![]()
3.胸部大動脈の手術
真性動脈瘤(しんせいどうみゃくりゅう)
主に動脈硬化、動脈壁の変性により大動脈の一部がこぶ状に膨らみ放置すると破裂から死亡に至る病気です。
通常痛みなどの自覚症状は出にくいので、レントゲンなどで偶然見つかることが多くみられます。声のかすれが初発症状のこともよくあります。大動脈弓部(だいどうみゃくきゅうぶ)という大動脈が首の下で180度Uターンする部分が好発部位です。瘤の部分を含めて大動脈弓部を人工血管で置換します。弓部からは脳に至る血管が起始しているため手術中の脳保護が必要となります。当科では中等度低体温下に頸部の血管に冷却血液を送る方法(脳分離体外循環)を用いて手術を行っています。麻酔時間を除いた正味の手術時間は通常4時間から5時間程度です。胸部大動脈瘤の中では定型的手術ですので、待機手術の死亡は5%以下です。上行大動脈や下行大動脈の瘤の場合も、瘤のできた部位を人工血管で置き換える手術を行います。破裂例の緊急手術も年間数例あります。破裂していても一旦小康状態になった状態で手術できればおおむね救命可能です。しかし術前心停止に陥ってしまった場合など、なかなか救命は困難です。従って破裂する前に手術をするのが望ましいのですが、動脈瘤は仮に明日破裂する運命にあっても破裂するまでは痛くも苦しくもないのが心臓の病気との大きな違いです。現在、開胸手術でなくステントグラフトで治療可能な場合はできるだけそうしています。
急性大動脈解離(きゅうせいだいどうみゃくかいり)
大動脈の壁が突然裂けて外側の薄皮一枚(外膜)だけで破裂を免れている状態です。
極めて珍しい病気ではなく、ときどき芸能人がこの病気で手術を受けたり、手術が間に合わず亡くなったりしたのが報道されます。裂けている範囲により2つのタイプがあります。心臓に近い部分まで裂けている場合(A型解離)急性期に高確率で破裂、死亡に至るため一刻も早い手術が必要となります。破裂の危険の高い部分を人工血管で取り替えます。すでに激しく破裂している場合は救命がかなり困難となります。24時間当直体制で速やかに手術対応しています。独自の手術マニュアルを作成し、学会中などスタッフが手薄な時も間違いのない手術ができるようにしています。手術室がどうしてもいっぱいの場合を除き、他院からの手術依頼は断りません。胸部下行大動脈だけが裂けているタイプ(Ⅲ型、B型)は通常手術をせずに安静により固まるのを待ちます。
最近では、B型解離に対して亜急性期、慢性期にステントグラフト治療を行っています。
TEVAR 胸部ステントグラフト内挿術
バネ付きの人工血管を大動脈内で膨らませ内貼りし、動脈瘤の破裂を防ぐ治療です。ステントグラフトは、通常は足の付け根の血管を出して、その血管から金属の枠(ステント)付きの人工血管を大動脈まで入れていきます。お腹を切ったり、胸を開けたりする必要がないので、患者さんの負担が少なく、術後数日から1週間程度で退院することができます。
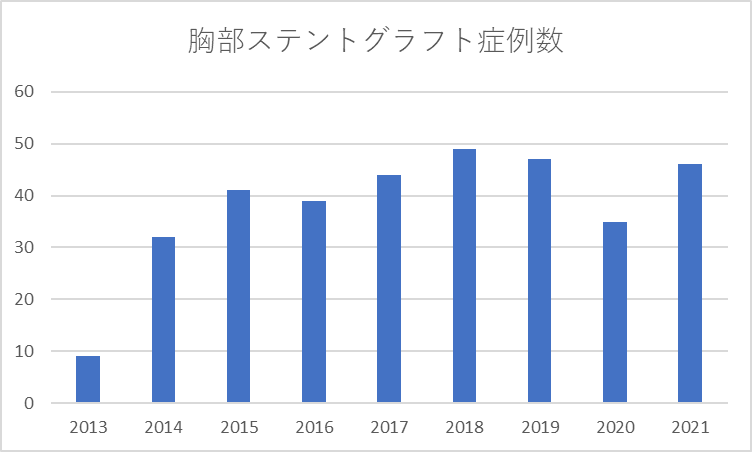
胸部ステントグラフトは、当初は開胸手術が困難なハイリスク症例のみに行われていましたが、短期成績のみならず、長期予後も比較的良いことが明らかとなってきました。そのため手術が可能な方でも、解剖学的にステントグラフトで治療できそうであれば積極的に適応するようになりました。現在では胸部大動脈手術の半数程がステントグラフト治療となってきています。
また、亜急性期や慢性期の解離性大動脈瘤に対しても、広汎な開胸開腹手術は侵襲も大きく、成績も悪いため、ステントグラフトを用いた治療を選択したり、開胸開腹手術との二期的なハイブリッド手術を選択することで、予後を改善できると考えています。
主に解剖学的な条件によって、全ての患者さんに対してステントグラフトができるわけではなく、レントゲンを見ながら遠隔操作で治療を行いますので、不確実な面もあります。当院では、開胸手術、ステントグラフトの症例数も多く、両方の治療に関して経験が豊富であるため、個々の患者さんに最も適した治療を提案できると考えています。
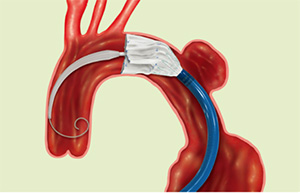
提供:Cook Japan
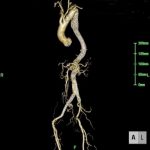
ハイブリッド手術の1例
![]()
4.TAVI(カテーテル大動脈弁植え込み術)
手術に代わる弁膜症治療、細い管を通して人工弁を植え込みます。
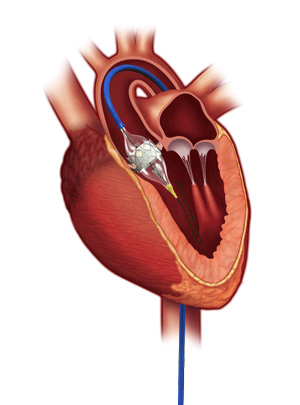
大動脈弁狭窄症は、心臓の出口である大動脈弁が硬くなり、心臓(左心室)から血液を駆出するのが困難となる病態です。その自然予後は悪く、従来の手術は人工心肺を用いて、心臓を止めて人工弁を縫い付ける大動脈弁置換術しかありませんでした。
TAVIは足の付け根、あるいは小切開開胸での心尖部からのアプローチにより、レントゲンを見ながら、大動脈弁の位置に経カテーテル的に人工弁を留置する手術です。人工心肺を使用したり、心臓を止める必要もなく、創も数センチ程度と非常に小さいため、患者さんの体の負担が非常に少ないのが特徴です。
数年前から欧米で始められたTAVIはすでに世界60カ国で行われており、90,000例を超える実績があります。日本でも2013年秋に承認され、認定施設で行えるようになりました。
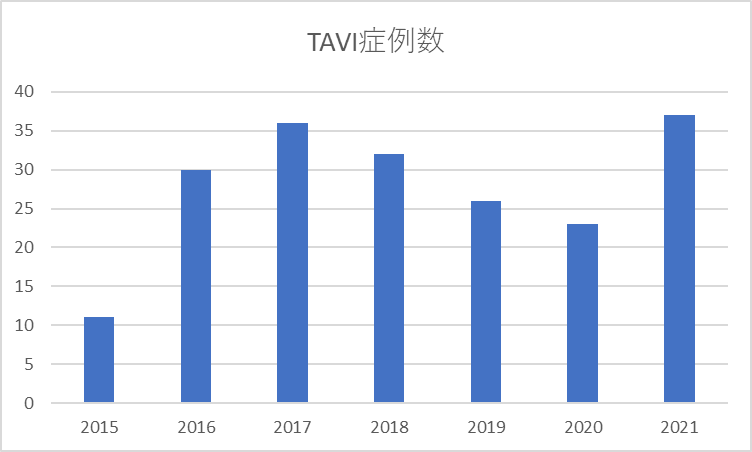
当院も2014年夏にハイブリッド手術室を稼働させ、2015年2月に認定施設を取得し治療を始めました。2016年末までに、41例施行し、全例成功しています。2017年には年間36件行いました。2018年は36件、2019年は26件でした。
対象は硬化による大動脈弁狭窄症で、従来の大動脈弁置換術がハイリスクと思われる症例です。80歳代後半など高齢の患者さんや他の合併症があったり、以前の心臓手術の既往などがある患者さんが当面の対象と思われますが、治療そのものは非常に低侵襲であり、中期的な予後も大動脈弁置換術後と遜色ないことが分かってきています。
現状では透析中の患者さんに関しては、保険適応外となっています。また、解剖学的な条件もあり、適応に関しては最終的にハートチームカンファレンスで決定します。患者さんによって、上記MICS手術や正中切開での手術が良い場合もありますが、いずれにしても患者さん一人一人に一番良い治療を検討していきますので、当院心臓血管外科、あるいは循環器内科外来でご相談ください。
![]()
5.MitraClip経皮的僧帽弁接合不全修復術
僧帽弁閉鎖不全症の新しい治療法
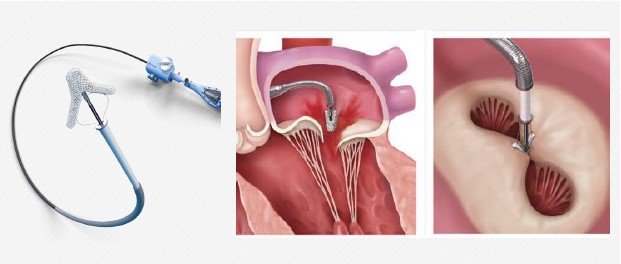
マイトラクリップは2018年より開始された僧帽弁閉鎖不全症に対する比較的新しい治療法です。
重症僧帽弁閉鎖不全症は通常外科的な修復 (僧帽弁形成術/置換術) が必要になりますが、手術のリスクが非常に高くなることもあります。
・高齢/フレイル
・心機能が非常に悪い
・心臓手術の既往がある
・悪性腫瘍、肺気腫など重篤な既往
このような患者様に対しても1週間以内に自宅退院が可能です。
治療後は心臓関連死亡や心不全入院が減少することが証明されています。
ご希望やご質問等ございましたら 心臓外科 細羽までお気軽にご相談ください。
6.術者の選定について
術者の選定は基本的に手術の難易度に応じて決めています。難易度の比較的高い場合は部長、副部長が術者となります。難易度が中等度の場合は医員が術者となります。難易度の低い手術は心臓外科にはありません。
医員が術者の場合も、部長または副部長が第一助手となり手術を監督指導しています。一見、全ての手術を最も習熟した術者が行う方が成績が良くなると思われるかもしれません。また、自分の手術は若い医者ではなく経験を積んだ医者にやって欲しいと思うのもよく理解できます。
しかし、特定の医師だけが術者となり他の者が助手ばかりで技術がまったく身に付いていない場合、チームの総合力が問われる本当に難しい手術や緊急時への対応力は低くなり施設の治療成績が低下します。また、国が定めた新専門医修練制度も始まりましたので、当院に限らずほぼ全ての施設において修練医に一定の手術機会が生じます。いずれにしてもテレビドラマのように「スーパースターが居て、あとは引き立て役だけ」では実際の医療は成り立ちませんので、全体のレベルの押し上げのために若手医師の教育と執刀機会が必要なのは疑いありません。
上記の事情はありますが、患者さんによる術者の希望がある場合は尊重しますので、忖度を期待するのではなく、外来の時点ではっきりと言っていただくと助かります。(伊藤)
へ。(担当:伊藤)
電子メールで、バイパス手術、弁膜症、胸部大動脈瘤手術、MICS手術(弁膜症、ASD、VSD)、その他相談を承ります。得られた情報の範囲で、できるだけ正確にお答えしたいと思いますので、お気軽にお問い合わせください。氏名、生年月日をお知らせいただけば病院の患者IDを作成して初診予約も可能です。
手術見学をご希望の場合
学生さんの場合、原則的に所属大学から総務課経由でお申し込みください。ドクターの場合、私伊藤まで上記アドレスに直接メールをください。業者さん経由で間接的に連絡されるだけでなく、是非直接疑問点などをお知らせください。MICS手術の見学に関しては、「実際ホントに学会で言っている通りなの?」と、ちょっと見てみたい場合でも受け入れています。
2009年~業績(医学雑誌掲載論文のみ。学会発表は省略)
- 伊藤敏明. HEART’s Selection2. DES時代の冠動脈バイパス術に与えられた使命. 心臓 2009;41:101-5.
- 吉住 朋、伊藤敏明、中山雅人、阿部知伸、萩原啓明、河村朱美、砂田将俊. 大動脈縮窄症根治術後遠隔期に上行大動脈瘤および大動脈弁閉鎖不全を発症した一例. 胸部外科 2009;62:1170-3.
- 中山雅人、伊藤敏明、阿部知伸、山名孝治、河村朱美、吉住朋、砂田将俊.感染性心内膜炎を合併した心室中隔欠損および大動脈弁閉鎖不全症の一例. 胸部外科 2009;62:822-5.
- Ito T, Abe T, Yamana K, Yoshiazumi T, Kawamura A, Sunada S. Foldback technique for aortic anastomosis of free right internal thoracic artery in coronary artery bypass grafting. Gen Thoracic Cardiovasc Surg 2009;57:678-80.
- Abe T, Ito T, Sunada M, Yoshizumi T, Kawamura A, Yamana K. Transapical aortic cannulation via left lateral thoracotomy for descending thoracic and thoracoabdominal aortic surgery. Gen Thoracic Cardiovasc Surg 2009;57:605-8.
- 中山雅人、伊藤敏明、阿部知伸、山名孝治、河村朱美、吉住朋、砂田将俊. 心房中隔欠損と肥大型心筋症を合併したNoonan症候群. 胸部外科 2009;62:535-7.
- 吉住朋、伊藤敏明、中山雅人、阿部知伸、萩原啓明、中山智尋. 大動脈弁逆流を伴う未破裂Valsalva洞動脈瘤に対する弁形成、パッチ閉鎖術.胸部外科 2009;62:219-21.
- 砂田将俊、伊藤敏明、中山雅人、阿部知伸、萩原啓明、河村朱美、吉住 朋. 胸部大動脈瘤食道穿破の1例.胸部外科 2009;62:247-9.
- Yamana K, Ito T, Maekawa A, Yoshizumi T, Sunada M, and Hoshino S. Atherosclerotic Arch Aneurysm Operations With Perfusion Toward the Aortic Valve. Ann Thorac Surg 2010;89:435-9
- Ito T, Maekawa A, Yamana K, Yoshizumi T, and Sunada M. Use of an extended polytetrafluoroethylene patch as an artificial leaflet in mitral valve plasty: an early experience. Ann Thorac Surg 2010;89:1620-4.
- Ito T, Hagiwara H, Maekawa A. Early and late results of entire septal patch technique for post infarction ventricular septal rupture. Gen Thorac Cardiovasc Surg 2012;60:475-9.
- Ito T, Maekawa A, Fujii G, Sawaki S, Hoshino S, Hayashi Y. Marked discrepancy in pressure gradient between Doppler and catheter examinations on Medtronic Mosaic valve in aortic position. Gen Thorac Cardiovasc Surg 2012;60:818-21.
- Ito T, Maekawa A, Sawaki S, Fujii G, Hoshino H, Hayashi Y. Reconstruction of mitral valve chordae and leaflets with one piece of autologous pericardium in extensively destructed mitral valve due to active endocarditis. Gen Thorac Cardiovasc Surg 2013;61:571-3.
- Ito T, Maekawa A, Hoshino H, Hayashi Y. Right infraaxillary thoracotomy for minimally invasive aortic valve replacement. Ann Thorac Surg 2013;96:715-7.
- Hayashi Y, Ito T, Maekawa A, Sawaki S, Fujii G, Hoshino H, Tokoro M, Yanagisawa J. Ascending aorta replacement late after aortic valve replacement. Kyobu Geka 2013;66:523-6.
- Ito T, Maekawa A, Aoki M, Hoshino S, Hayashi Y, Sawaki S, Yanagisawa J, Tokoro M. Seamless reconstruction of mitral leaflet and chordae with one piece of pericardium. Eur J Cardiovasc Surg 2014;45:e227-32.
- Hayashi Y, Ito T, Maekawa A, Sawaki S, Hoshino S, Tokoro M, Yanagisawa J. Reoperative cardiac surgery after previous coronary artery bypass grafting. Kyobu Geka. 2014 Jun;67:433-7
- Sawaki S, Ito T, Maekawa A, Hoshino S, Hayashi Y, Yanagisawa J, Tokoro M, Ozeki T. Outcomes of video-assisted minimally invasive approach through right mini-thoracotomy for resection of benign cardiac masses; compared with median sternotomy. Gen Thorac Cardiovasc Surg. 2015;63:142-6.
- Ito T. Informed consent in valvular diseases. Nihon Geka Gakkai Zasshi. 2014;115:259-61.
- Ito T, Maekawa A, Hoshino S, Hayashi Y. Right infra-axillary mini-thoracotomy for aortic valve replacement. Ann Cardiothorac Surg. 2015 Jan;4:57-8.
- Aoki M, Ito T. New method of posterior scallop augmentation for ischemic mitral regurgitation. Ann Thorac Surg. 2015 Mar;99(3):1087-9
- Ito T. Minimally invasive mitral valve surgery through right mini-thoracotomy: recommendations for good exposure, stable cardiopulmonary bypass, and secure myocardial protection. Gen Thorac Cardiovasc Surg. 2015 Apr 4. [Epub ahead of print]
- Hayashi Y, Ito T, Maekawa A,Sawaki S, Tokoro M, Yanagisawa J, Murotani K. Effect of modified proximal anastomosis of the free internal thoracic artery: piggyback and foldback techniques. Inreract Cardiovasc Thorac Surg 2016;22:265-72.
- Ito T, Tokoro M, Yanagisawa J. Mitral valve plasty for a hammock valve in an adult patient. Inreract Cardiovasc Thorac Surg 2015;21:393-5.
- Ito T. TECHNIQUES IN MITRAL VALVE REPAIR VIA A MINIMALLY INVASIVE APPROACH. Nihon Geka Gakkai Zasshi. 2016;117:120-3. Japanese
- Ito T. Minimally Invasive Mitral Valve Plasty;My Technique. Kyobu Geka. 2016 ;69(8):607-11. Japanese.
- Ito T, Maekawa A, Hoshino S, Hayashi Y, Sawaki S, Yanagisawa J, Tokoro M. Three-port (one incision plus two-port) endoscopic mitral valve surgery without robotic assistance. Eur J Cardiothorac Surg. 2017 ;51:913-918.
- Tokoro M, Ito T, Maekawa A, Sawaki S, Yanagisawa J, Ozeki T, Orii M. Trans-right axillary aortic valve replacement: propensity-matched comparison with standard sternotomy approach. Interact Cardiovasc Thorac Surg. 2017 ;25(4):521-525.
- Hayashi Y, Maekawa A, Sawaki S, Tokoro M, Yanagisawa J, Ozeki T, Usui A, Ito T. Long-term patency of on- and off-pump coronary artery bypass grafting with bilateral internal thoracic arteries: the significance of late string sign development in the off-pump technique. Interact Cardiovasc Thorac Surg. 2017 Nov 1;25(5):799-805.
- Yanagisawa J, Maekawa A, Sawaki S, Tokoro M, Ozeki T, Orii M, Saiga T, Ito T. Three-port Totally Endoscopic Repair vs Conventional Median Sternotomy for Atrial Septal Defect.Surg Today 2019 Feb;49(2):118-123.
- Tokoro M, Sawaki S, Ozeki T, Orii M, Usui A, Ito T. Totally Endoscopic Aortic Valve Replacement via an Anterolateral Approach Using a Standard Prosthesis. Interact Cardiovasc Thorac Surg 2020 Mar 1;30(3):424-430.
- Hayashi Y, Maekawa A, Sawaki S, et al. Left-Sided Complete Revascularization With Bilateral Internal Thoracic Arteries in Patients With Diabetes. Ann Thorac Surg. 2019;107(6):1727-1735.

